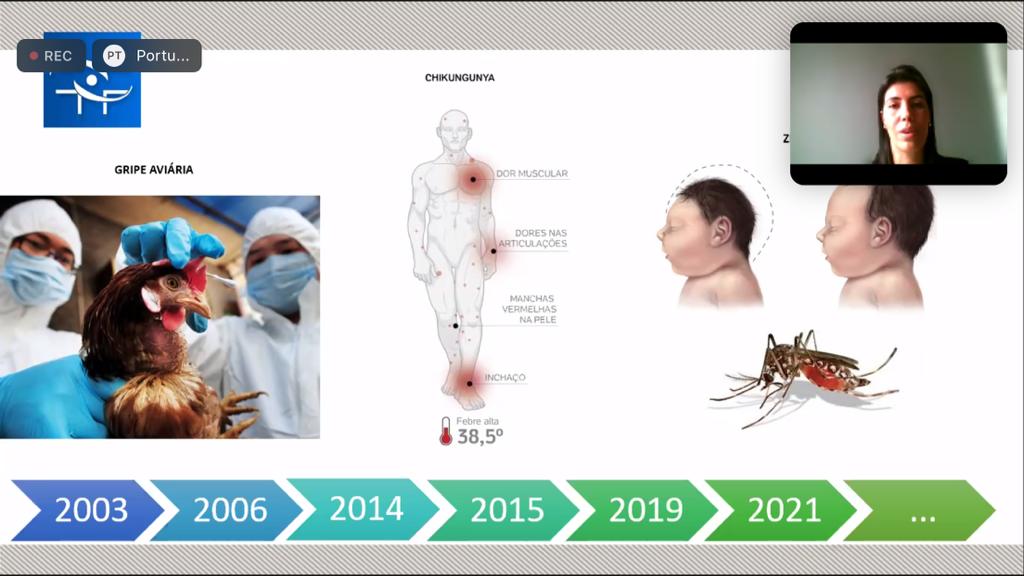
No segundo dia de Seminário ‘Dispositivos médicos: regulação, avanços e perspectivas’, Marcella Abreu, representando a Gerência-Geral de Tecnologia de Produtos para Saúde (GGTPS) e Gerência de Produtos para Diagnóstico in vitro (GEVIT) da Anvisa, apresentou os avanços na regulação de IVDs no cenário Covid19 e os destaques recentes de produtos e tecnologias médicas. Segundo ela, um dos principais desafios na pandemia foi balizar riscos e acesso e o conhecimento foi ponto chave para tomadas de decisões. Foram fundamentais no trabalho: priorização das análises dos pedidos de registros, com agilidade; flexibilização em regulamentos técnicos; transparência das informações; ênfase no conhecimento – atualização técnica e científica; e avaliação de cenários e riscos.
No mesmo painel, moderado pelo vice-presidente da ABIIS, Carlos Eduardo Gouvêa, o presidente da Câmara Brasileira de Diagnóstico Laboratorial (CBDL), Fábio Arcuri, destacou que “o Brasil se encontra em uma posição bastante madura e isso é resultado do diálogo entre as entidades, os setores regulado e regulador. O avanço foi notório e se olharmos para a América Latina, estamos bastante avançados”. O executivo fez uma apresentação baseada no ‘Livro Branco do Diagnóstico Laboratorial 2021/2022’, recém lançado, com propostas para o desenvolvimento de políticas públicas e privadas que promovam a ampliação do acesso da população a saúde, nas quatro fases do produto que compõem o ciclo do IVD: tecnologias inovativas, regulação, acesso e monitoramento e gestão.
O evento debateu também a Identificação Única de Dispositivos Médicos ou UDI (Unique Device Identification). Hélio Macêdo, da Gerência-Geral de Tecnologia de Produtos para Saúde (GGTPS), apresentou os desafios e próximos passos para implementação. Dos Estados Unidos, John Terwilliger, da Abbott, afirmou que a UDI é muito importante e precisa ser baseada em normas internacionais. Segundo ele, reduz custos para fabricantes, stakeholders e pacientes; aumenta a rastreabilidade nas cadeias de suprimentos globais; promove a transparência entre os reguladores; e permite uma linguagem comum entre indústria e reguladores. O diretor técnico da Associação Brasileira de Importadores e Distribuidores de Produtos para Saúde (ABRAIDI), Sérgio Madeira, moderou o painel.
Para 2022, a Anvisa tem algumas prioridades, destacadas por Leandro Pereira, da Gerência-Geral de Tecnologia de Produtos para Saúde (GGTPS): a Consulta pública 1.039/2021 que possibilita o uso de avaliações realizadas por autoridades estrangeiras para fins de regulação junto a Agência e o Medical Device Single Review Program (MDSRP) ou Programa de Auditoria Única de Dispositivos Médicos. A agenda regulatória prevê a Identificação Única de Dispositivos Médicos (UDI); regulação de software como dispositivos médicos; regulamentação sobre importação, comercialização e doação de dispositivos médicos usados e recondicionados; regularização de implantes ortopédicos (revisão da RDC 59/2008); reprocessamento de dispositivos médicos; e revisão dos requisitos de agrupamento de materiais de uso em saúde. Representando a indústria, Murilo Contó, da Boston Scientific, e Eduardo Simões, da Implamed, completaram o painel, mediado pelo presidente da ABIIS.
Bruno Boldrin Bezerra fez questão de encerrar o evento com um chamado ao governo e ao setor. “Dos 80 mil dispositivos médicos autorizados pela Anvisa, 31% são nacionais e 69% importados. O Brasil precisa colocar o setor de DMs como estratégico para que o país tenha capacidade de suprimento, independente do capital de origem. Queremos que o setor se desenvolva e cresça para que a população tenha acesso a produtos de qualidade e com rapidez”, finalizou.
O evento completo e todas as apresentações dos palestrantes em PDF estão disponíveis clicando aqui.












DIA 02 – Dispositivos médicos: regulação, avanços e perspectivas